Czy Twój biomateriał jest naprawdę BIO?
Wprowadzenie
Biomateriał? Implant? Endoproteza? Soczewka? Biozgodność?
Jeżeli działasz w obszarze materiałów do zastosowań biomedycznych doskonale zdajesz sobie sprawę z tego jak istotna jest ich biokompatybilność. Oraz z tego, że jest ona pochodną wielu właściwości, między innymi: struktury, składu chemicznego – “czystości” chemicznej, chropowatości powierzchni oraz właściwości mechanicznych i tribologicznych.
Wyznaczenie tych cech stanowi pierwszy etap klasyfikacji materiału jako BIO przed wykonaniem jego oceny biologicznej, chociażby w testach cytotoksyczności in vitro.
Poniżej opowiemy o technikach na co dzień wykorzystywanych w badaniu różnego typu biomateriałów, tj.
🔹 mikroskopia elektronowa,
🔹 AFM,
🔹 AFM-IR,
🔹 mikroskopia 3D,
🔹 nanoindentacja.
Mikroskopia elektronowa w obrazowaniu nanowydzieleń
Inżynieria materiałowa, fizyka, chemia, biologia, medycyna… w każdym z tych obszarów mikroskop elektronowy stanowi nieocenione narzędzie w charakteryzacji właściwości strukturalnych, rozkładu pierwiastków lub obserwacji przemian in situ, a także odstępstw od „normalnego” lub naturalnego stanu rzeczy.
W badaniu biomateriałów oprócz badań strukturalnych, topografii powierzchni, SEM i TEM stają się narzędziami, które niosą informacje o dystrybucji pierwiastków, właściwościach mechanicznych (odpowiednie przystawki do kolumn mikroskopów) lub rozkładzie porów (zaawansowane oprogramowanie do tomografii elektronowej). Jest to kluczowe w zrozumieniu powiązań między właściwościami i w optymalizacji tych właściwości.
W dużym skrócie, mikroskopia elektronowa:
🔹 umożliwia analizę struktury powierzchniowej i struktury wewnętrznej biomateriałów stosowanych na implanty i endoprotezy, co ma kluczowe znaczenie dla zrozumienia ich biokompatybilności oraz wpływu na tkanki,
🔹 pozwala na obrazowanie struktur i nanowydzieleń w różnego typu stopach przeznaczonych na instrumentarium chirurgiczne, co pozwala na optymalizację procesu wytwarzania,
🔹 w połączeniu z zaawansowanym oprogramowaniem to źródło wiedzy o strukturach rusztowań komórkowych, w tym biodegradowalnych skafoldów kolagenowych,
🔹 pozwala na dokładną analizę nanocząsteczek, co jest istotne dla projektowania nośników leków, nanomateriałów diagnostycznych i innych zaawansowanych terapii,
🔹 umożliwia badanie ultrastruktury komórkowej i tkankowej, co jest kluczowe dla oceny wpływu biomateriałów na mikroskalę biologiczną.
Z ciekawostek: inspiracją do napisania tego fragmentu stało się zdjęcie, które widoczne jest poniżej. Przedstawia ono segregację nanometrowych wydzieleń Cu/Nb wzdłuż granic ziaren w nierdzewnej stali chirurgicznej. Piękne! – prawda?
Takie zwizualizowanie było możliwe dzięki wykorzystaniu specjalistycznego pakietu oprogramowania, które obok danych z mikroskopu, wnosi szczególny wkład we współczesną mikroskopię elektronową.
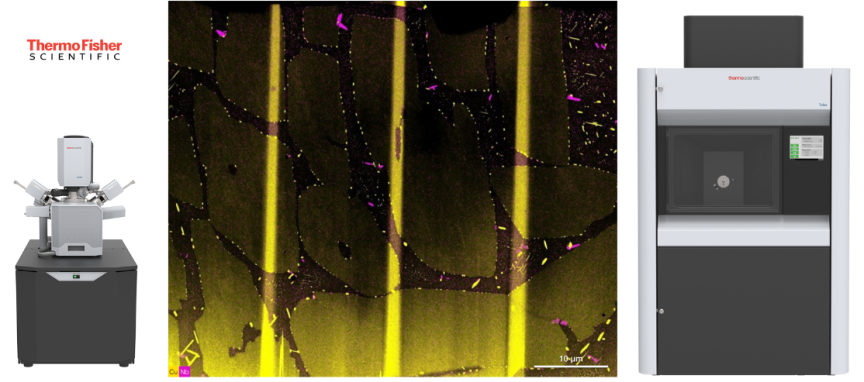
Podsumowując: mikroskopia elektronowa stanowi nieodłączny składnik nowoczesnych badań biomateriałów, umożliwiając dokładną analizę struktury w szerokim zakresie powiększeń. Jej wszechstronne zastosowanie przyczynia się do rozwijania innowacyjnych biomateriałów o zoptymalizowanych właściwościach, a także do lepszego zrozumienia interakcji między materiałami a organizmami żywymi.
Mikroskopia sił atomowych AFM w badaniu nanowłókien
Biomateriały, kluczowe dla dziedzin takich jak inżynieria tkankowa, medycyna regeneracyjna i implantologia, są obszarem intensywnych badań przy zastosowaniu AFM. Ta zaawansowana technika umożliwia nie tylko ocenę topografii powierzchni biomateriałów z ultrawysoką rozdzielczością, ale także na precyzyjne określanie ich właściwości wytrzymałościowych i fizykochemicznych.
Warto w tym miejscu zaznaczyć, że inspiracją do powstania publikacji był obraz AFM przedstawiający nanowłókna oraz punkt zerwania jednego z nich w pomiarach nanomechanicznych. Badanie właściwości wytrzymałościowych jest nieodzowne m.in. w opracowywaniu nowoczesnych rusztowań z włókien polimerowych, które mogą znaleźć zastosowanie w inżynierii tkankowej, umożliwiając uzupełnianie różnego rodzaju ubytków tkankowych.

AFM to jednak nie tylko narzędzie do badania struktury i wspomnianych właściwości materiałowych. AFM daje sposobność prowadzenia badań nad adhezją komórek lub płytek krwi do powierzchni biomateriału. Te wstępne testy pozwalają zweryfikować właściwości powierzchni biomateriału i zmodyfikować proces jego wytworzenia w kierunku poprawy hemozgodności, jeszcze przed przystąpieniem do testów oceny biozgodności.
Co więcej, nowoczesne tryby pracy AFM i dostępne moduły otworzyły w ostatnich latach nowe możliwości badawcze. Możliwe stało się miedzy innymi wykonywanie badań dynamicznych procesów biologicznych w warunkach zbliżonych do naturalnych (ciecz, pH, temperatura). Te nowe perspektywy wnoszą ogromny wkład w zrozumienie interakcji biomateriałów z organizmami żywymi.
AFM-IR w opracowaniu nanonośników leków
Przy opracowaniu nanonośników leków do potencjalnych zastosowań w terapii celowanej kluczową rolę odgrywa zrozumienie mechanizmów ich działania na poziomie molekularnym. By wykorzystać ich pełen potencjał, musimy zapewnić wysoką biokompatybilność nanostruktur, która jest pochodną między innymi składu chemicznego oraz tego w jaki sposób sfunkcjonalizowano ich powierzchnię.
Potencjał techniki AFM-IR (ang. Atomic Force Microscopy – Infrared Spectroscopy) w rozwoju terapii celowanych i leczenia opartego na nanonośnikach jest ogromny. Jej zdolność do dostarczania precyzyjnych informacji strukturalnych i chemicznych na poziomie molekularnym otwiera niezwykłe możliwości kształtowania systemów dostarczania leków i zrozumienia ich oddziaływania z docelowymi komórkami lub tkankami. Dzięki temu możemy optymalizować budowę i sposób funkcjonalizacji nanonośników w kierunku poprawy ich skuteczności i bezpieczeństwa.

Dane uzyskane techniką AFM-IR niosą informacje nie tylko o składzie chemicznym i morfologii biomateriałów, ale w przypadku nanocząstek, pozwalają analizować poszczególne składowe ich budowy, z ang. core i shell, oraz oceniać stopień ich degradacji. Co ważne, dzięki rozdzielczości przestrzennej obrazowania IR rzędu 10 nanometrów, możemy dokładnie zlokalizować miejsca gromadzenia się zastosowanego leku a także badać proces penetracji nanonośników przez tkanki, np. tkanki skórne, kostne.
Nanoindentacja w badaniu hydrożeli
W tym rozdziale przybliżymy temat badania właściwości mechanicznych materii miękkiej. Przykładem takich materiałów są hydrożele, wykorzystywane do produkcji soczewek, oraz materiały stosowane w inżynierii tkankowej do regeneracji tkanek, do odbudowy ubytku chrząstki.
W przypadku soczewek kontaktowych, właściwości mechaniczne, takie jak moduł Younga, twardość oraz odporność na zużycie ścierne mają bezpośredni wpływ na komfort ich noszenia, a także na ich właściwości optyczne.
Natomiast w kontekście biomateriałów stosowanych do uzupełnienia ubytków chrząstki stawowej, testy nanoindentacyjne stają się kluczowe w pozyskaniu informacji o anizotropii materiału i jego strukturze.
Jednym z dostępnych narzędzi, które pozwalają wykonać powyższe testy, jest indenter in-situ Hysitron BioSoft widoczny na grafice. W to rozwiązanie może zostać doposażony dowolny mikroskop odwrócony.

Moduł jest zoptymalizowany do prowadzenia testów nanotribologicznych i nanomechanicznych na różnorodnych substancjach miękkich, ale także na preparatach biologicznych (od fragmentów kości, chrząstek stawowych, po rogówkę czy tkankę mózgową). Pozwala na badania próbek niejednorodnych, o małym module Younga (0,01 – 1000 MPa) oraz wymagających określonych warunków pomiaru. Przykładem są tu hydrożele, które podczas pomiarów muszą pozostać w postaci uwodnionej by zachować swoje właściwości.
Zrozumienie i kontrola właściwości mechanicznych biomateriałów są kluczowe dla projektowania materiałów (implanty, protezy, sztuczne organy), które zarówno spełniają założoną funkcjonalność, jak i są bezpieczne dla organizmu. Właściwie opracowane biomateriały minimalizują ryzyko odrzutu immunologicznego i innych niepożądanych efektów, co przekłada się na ich wysoką biozgodność.
Mikroskopia 3D w badaniach implantów
Czy wiesz, że powierzchnia implantu ma kluczowy wpływ na jego integrację z tkanką kostną i biokompatybilność?
Właśnie dlatego w badaniach i kontroli jakości implantów ortopedycznych coraz częściej wykorzystuje się mikroskopię optyczną 3D.
Jakie są jej zalety?
🔹dokładny i niezawodny pomiar chropowatości, wysokości i kształtu mikro- i makrostruktur powierzchni,
🔹bezkontaktowość metody – brak ryzyka uszkodzenia powierzchni implantu,
🔹uniwersalność – możliwość badania różnych materiałów,
🔹szeroki zakres pomiarowy – radzi sobie zarówno z bardzo gładkimi, jak i chropowatymi powierzchniami,
🔹szybkość, dokładność i powtarzalność pomiarów,
🔹możliwość automatyzacji – szybsza kontrola jakości.
Mikroskopia optyczna 3D znajduje szerokie zastosowanie w badaniach nad implantami i może być pomocna w:
🔹ocenie wpływu chropowatości powierzchni na adhezję komórek i proliferację,
🔹pomiarze integracji implantu z kością,
🔹badaniu wpływu modyfikacji powierzchni na biokompatybilność,
🔹opracowywaniu nowych biomateriałów.
Przykład:
Na grafice widoczna jest powierzchnia PEEK (Polieteroeteroketon) – termoplastycznego biomateriału wykorzystywanego w implantach medycznych.
Pomiary wykonane za pomocą mikroskopii optycznej 3D pozwalają ocenić zmiany powierzchni po testach zużycia, co dostarcza cennych informacji o długoterminowej stabilności implantu.
